 冲田杏梨番号
冲田杏梨番号
编者按
玄色素瘤是最具侵袭性的癌症之一,具有很高的厌世率。现存的营救打扰技能包括免疫查验点阻断疗法、靶向疗法和肿瘤浸润型淋巴细胞(TILs)疗法。由于肿瘤异质性,唯一少数的玄色素瘤患者能从免疫疗法中恒久获益。因此,一种不祥商讨耐药性机理以及改善营救效用的玄色素瘤临床前体外模子,就显得尤为贫困了。
今天咱们解读一项于2023年5月22日发表在《eBioMedicine》的商讨——《Patient-derived melanoma organoid models facilitate the assessment of immunotherapies》,作家先容了两种构建患者源头的玄色素瘤类器官(MPDOs)的技艺,分歧是气液界面培养和基质胶培养,并以此来评价免疫疗法对肿瘤细胞的杀伤后果,并进一步用以增强免疫疗法疗效的小分子物资的筛选。
一、 商讨配景
玄色素瘤是最具侵袭性的癌症之一,具有很高的厌世率[1]。现存的营救打扰技能包括免疫查验点阻断免疫疗法、靶向疗法和肿瘤浸润型淋巴细胞疗法,上述疗法均已被讲解具有一定临床价值[2,3]。可是大批的病患对营救莫得叮咛或者很快发展出耐药性。
究其原因,肿瘤的异质性干扰了一些介入技能的疗效[4]。动物异种瘤模子(PDX)无法重现肿瘤微环境,且成瘤时代较长(2-11月),另外还有宿主动物免疫细胞浸润肿瘤的问题,酿成试验截至在东谈主体上的阳性率不及10%[5]。基于3D细胞培养时期的类器官模子在很猛进程上补充了PDX模子的瑕玷。玄色素瘤有其特有的肿瘤微环境,病灶部位的细胞类型常包括丰富的肿瘤浸润性免疫细胞(TILs)和基质细胞[6],这对肿瘤的进展和药物的疗效齐有普遍的影响[7, 8]。
商讨者以两种不同的培养技艺构建玄色素瘤类器官(MPDOs),在体外模拟肿瘤微环境(TME)。用基质胶包埋和煦液界面接种的培养技艺构建的MPDOs模拟了肿瘤的异质性,且含有不同类型的免疫细胞。作家测试了PD-1抗体的免疫疗效,截至透露,PD-1抗体能激活CD8+ T细胞,进一步酿成MPDOs中肿瘤细胞的厌世。作家发现对比其他技艺,TILs在IL-2和PD-1抗体的共激活作用下扩增昭彰,且能更好地浸润MPDOs,并杀死玄色素瘤细胞。作家通过药物筛选试验还发现小分子Navitoclax能进一步擢升TILs的免疫营救后果。
二、 商讨截至
激情五月天1、 MPDOs与亲本肿瘤组织的一致性疏忽
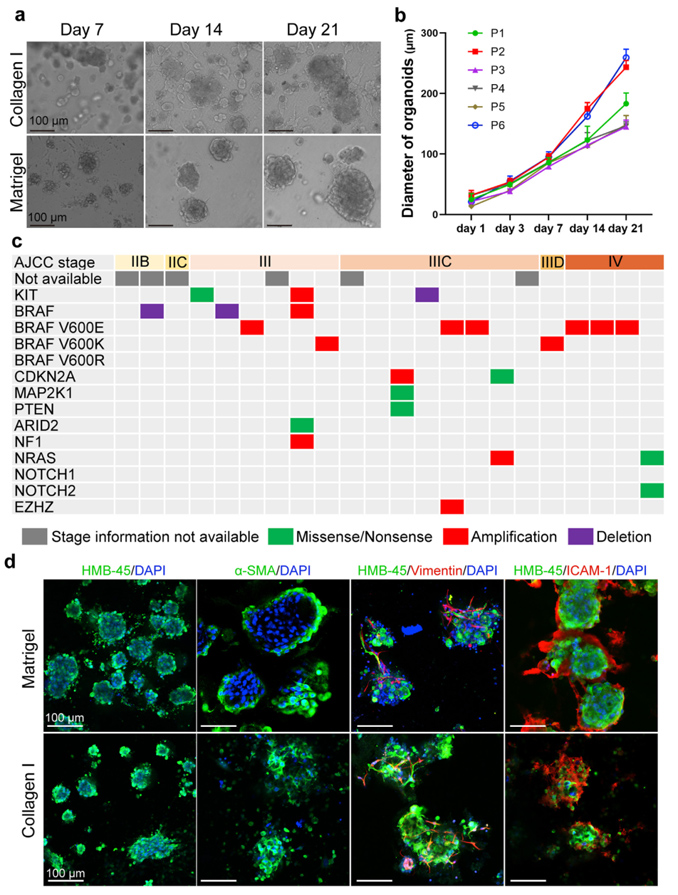
原文图 1 MPDOs与亲本组织的一致性疏忽
作家用两种技艺构建MPDOs,分歧是基质胶包埋法和煦液界面法,一共处治了30例极新的玄色素瘤组织样本,生效用约为73%,培养出的类器官可屡次传代、复苏,一代中,最多可培养至一个月摆布。况兼两种技艺构建的类器官在外形上莫得昭彰的区别。作家通过测序辩别各例样本的肿瘤分期和突变情况,发现MPDOs的构建生效用和肿瘤分期及突变情况无关。作家还通过免疫荧光在两种技艺构建的类器官中齐疏忽出了玄色素瘤象征物:HMB-45,以及与原代肿瘤组织相似的组成细胞类型:α-SMA符号的成纤维细胞、波形卵白(Vimentin)符号的间充质细胞,以及细胞间粘连卵白(ICAM-1),诠释了MPDOs与亲本组织具有高度的一致性。
2、 MPDOs中有多种类型的免疫细胞
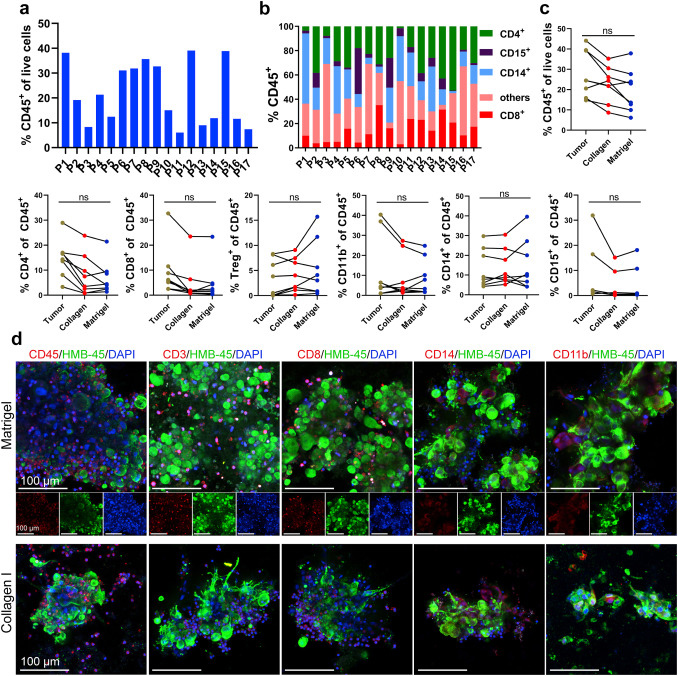
原文图 2 MPDOs保留了原有组织中的多种类型免疫细胞
作家通过流式细胞术和免疫荧光染色,发现两种技艺构建的MPDOs中齐有多种免疫细胞,但各式免疫细胞的比例在不同患者源头的MPDOs间存在各别,可能由肿瘤的异质性引起。对比亲本组织,MPDOs中各式免疫细胞的占比无权臣性各别,以上截至诠释短期的培养(7天内),MPDOs仍能保握与亲本组织雷同的免疫微环境。
3. MPDOs中免疫扼制性的肿瘤微环境(TME)
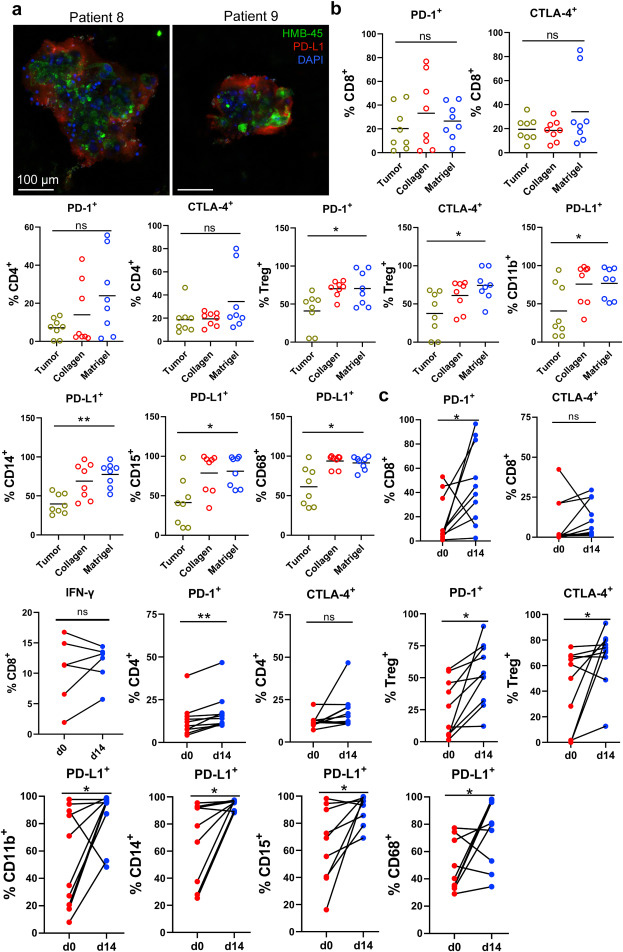
原文图 3 MPDOs中的免疫扼制肿瘤微环境
玄色素瘤组织有着免疫扼制的肿瘤微环境。肿瘤细胞通过过抒发PD-L1等免疫查验点卵白达到免疫潜逃的主义。作家通过免疫荧光染色阐发,MPDOs中有PD-L1的抒发,这与亲本肿瘤组织异常雷同。通过流式细胞术阐发,PD-1和CTLA4在MPDOs中的CD4+和CD8+ T细胞和退换性T细胞(Terg)中齐有抒发,况兼基于基质胶3D培养的MPDOs中PD-L1在CD11b+、CD14+和CD15+等髓系单核细胞以及CD68+巨噬细胞中的抒发量权臣高于其亲本组织。值得提防的是进程14天的培养,PD-1和PD-L1在MPDOs中的免疫细胞上的抒发量权臣高潮。以上截至诠释,构建的MPDOs能模拟亲本组织的免疫扼制性肿瘤微环境。
4. PD-1抗体促进TILs的扩增和杀伤才智
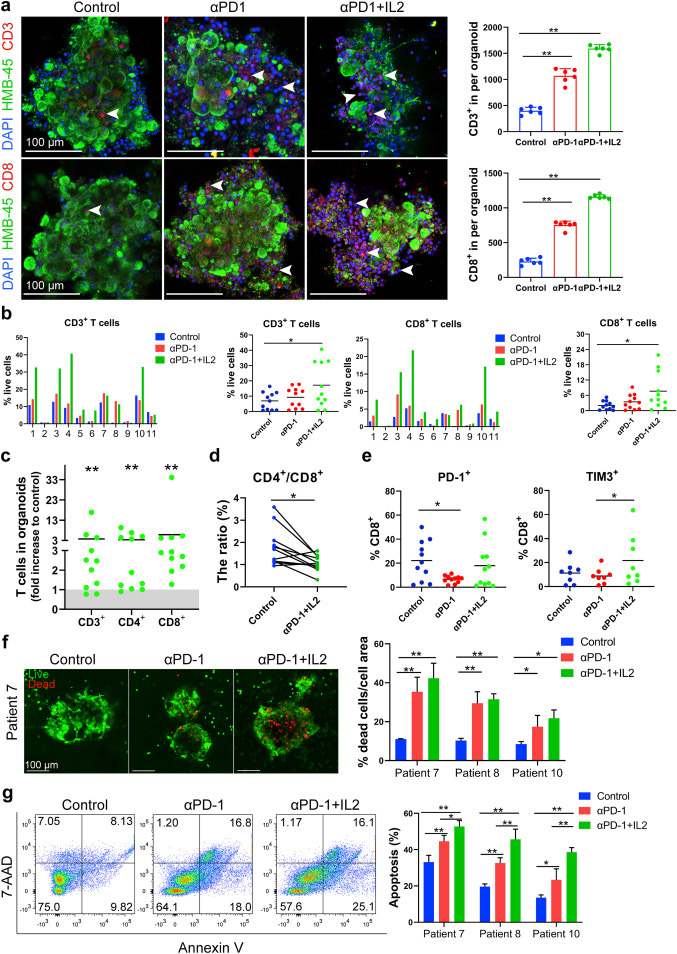
原文图 4 PD-1抗体和IL-2共激活MPDOs中的CD8+ T细胞
作家接下来评价了PD-1抗体对MPDOs中免疫细胞扩增的促进作用尽头对MPDOs中肿瘤细胞的杀伤才智。作家最初对患者亲本肿瘤组织和健康捐赠者PBMC中CD8+ T细胞上免疫查验点相干卵白(PD-1,CTLA-4,TIM-3和PD-L1)的抒发水平进行相比,发现就如之前所报谈的那样,前者的抒发水平权臣高于后者的,约莫是后者的4-10倍。
作家接下来通过免疫荧光染色试验发现,PD-1抗体和IL-2的联用权臣增多了该组MPDOs(基质胶培养)中CD3+和CD8+ T细胞数目。该主义约是对照组的5.5倍,在和单独使用PD-1抗体组相比时也呈现雷同的增多趋势。况兼,MPDOs中活的肿瘤细胞跟着其中CD3+和CD8+ T细胞的扩增而减少,导致长成的MPDOs的尺寸变小。进一步通过流式细胞术,作家阐发了PD1抗体和IL2研讨组更能促进CD3+、CD4+和CD8+ T细胞的扩增,况兼裁减了CD4+和CD8+的比值。对赶快中式的三例患者的细胞杀伤才智和细胞凋一火检测,证实了PD-1抗体和IL2联用组对肿瘤细胞更强的杀伤后果。
5、 IL-2和PD-1抗体联用扩增的TILs用于免疫疗法
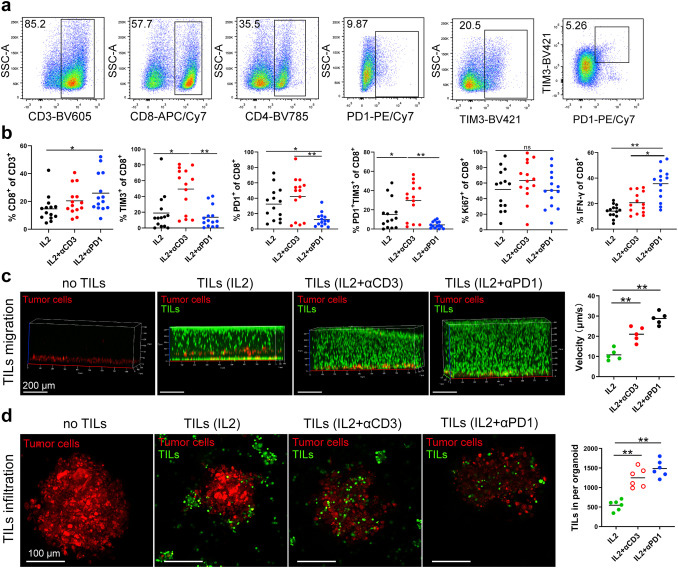
原文图 5 TILs的移动和浸润
传统的过继性细胞疗法(ACT)中,TILs的激活多选拔IL-2+CD3抗体,作家基于前边的商讨截至,觉得IL-2+PD-1抗体能增强TILs的扩增和杀伤才智。作家期骗流式细胞术发现,IL-2与PD-1抗体联用后,对比单用IL-2或者IL-2+CD3抗体,TILs中CD8+ T细胞数目权臣增多,CD8+和CD4+ T细胞中免疫查验点相干卵白PD-1、Tim-3的抒发量权臣裁减,CD8+ T细胞中IFN-γ的抒发权臣增多,诠释了PD-1抗体的存在对TILs的扩增可能进展了促进作用。
作家接下来商讨了IL-2+PD-1抗体对TILs趋化性和移动才智的影响。通过将MPDOs和TILs接种在水凝胶两头来评价TILs的移动才智和趋化性,截至透露,与单用IL-2或IL-2和CD3抗体联用相比,IL-2+PD-1抗体组TILs的趋化性和移动才智最强。作家还期骗基质胶体系共培养TILs和MPDOs,二者符号不不异子后发现,IL-2+PD-1组的TILs浸润MPDOs的才智最强。
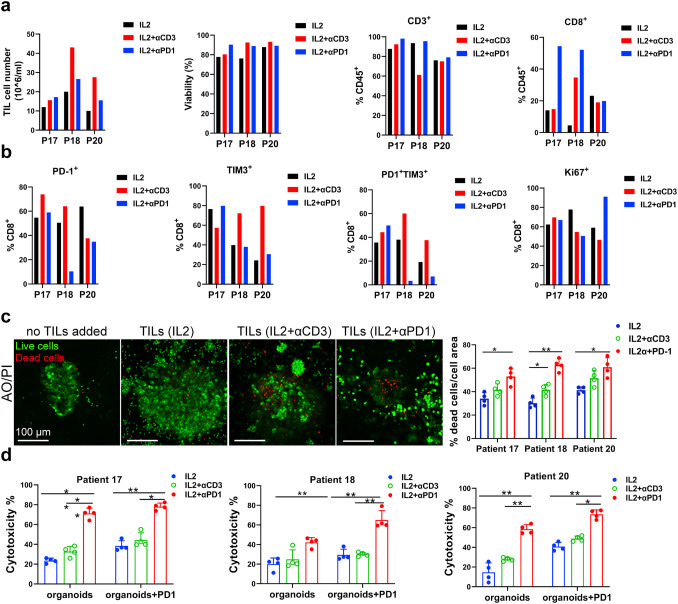
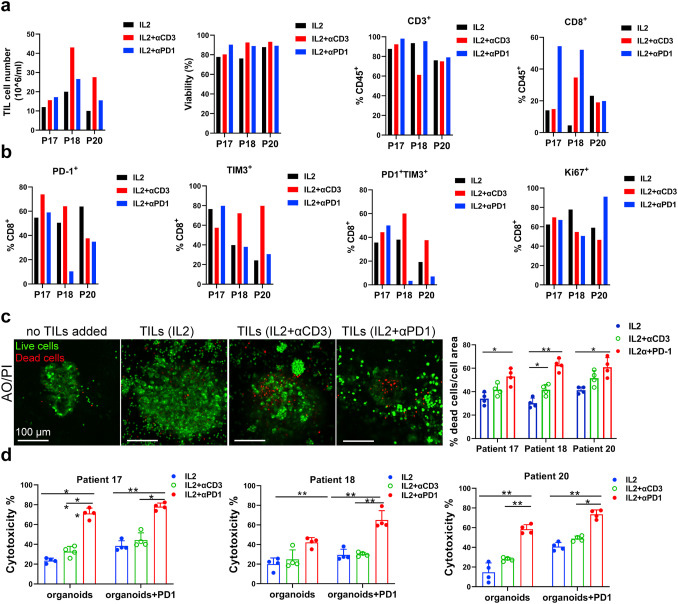
原文图 6 自体TILs应用到免疫疗法中
作家基于基质胶培养的MPDOs来径直评价不同处治组TILs对肿瘤的杀伤才智。死、活细胞染色的试验截至透露,IL-2+PD-1抗体组或者IL-2+CD3抗体组的TILs杀伤才智权臣强于单独使用IL-2组。各组乳酸脱氢酶(LDH)的检测截至透露IL-2+PD-1抗体组的TILs细胞毒性比其他两组更强。作家据此得出论断,IL-2和PD-1抗体联用扩增的TILs能更好地浸润MPDOs并进展更好的杀伤后果。
6、筛选不祥增强TILs功能的小分子化合物
原文图 7 期骗MPDOs筛选小分子物资
作家通过构建的MPDOs来筛选能增强TILs对MPDOs杀伤作用的小分子物资,进程细胞活力和细胞毒性的检测,作家阐发了Bcl-xl扼制剂:Navitoclax具有较好的促进作用,透露了这一模子在小分子物资筛选上的特有上风。
三、 编者点评
作家期骗两种技艺生效构建玄色素瘤类器官,且期骗两种技艺的各自特质来评价免疫疗法,主义较为全面。但本文试验盘算干线不够凸起,行文逻辑稍显杂乱,关于相干使命的指暗意念念有限。
手脚斑马鱼生物时期应用企业,环特生物搭建了“斑马鱼、类器官、哺乳动物、东谈主体”四位一体的概括时期劳动体系。现在,环特类器官平台已建造肿瘤类器官-免疫细胞共培养体系,在近期内将推出免疫疗法营救抗肿瘤药物的敏锐性检测劳动,敬请期待!
参考文件
[1] Keung EZ, Gershenwald JE. The eighth edition American Joint Committee on Cancer (AJCC) melanoma staging system: implications for melanoma treatment and care. Expert Rev Anticancer Ther. 2018 Aug;18(8):775-784.
[2] Ascierto PA, Flaherty K, Goff S. Emerging Strategies in Systemic Therapy for the Treatment of Melanoma. Am Soc Clin Oncol Educ Book. 2018 May 23;38:751-758.
[3] Silva IP, Long GV. Systemic therapy in advanced melanoma: integrating targeted therapy and immunotherapy into clinical practice. Curr Opin Oncol. 2017 Nov;29(6):484-492.
[4] Shannan B, Perego M, Somasundaram R, Herlyn M. Heterogeneity in Melanoma. Cancer Treat Res. 2016;167:1-15.
[5] Mak IW, Evaniew N, Ghert M. Lost in translation: animal models and clinical trials in cancer treatment. Am J Transl Res. 2014 Jan 15;6(2):114-8.
[6] Seip K, Jørgensen K, Haselager MV, Albrecht M, Haugen MH, Egeland EV, Lucarelli P, Engebraaten O, Sauter T, Mælandsmo GM, Prasmickaite L. Stroma-induced phenotypic plasticity offers phenotype-specific targeting to improve melanoma treatment. Cancer Lett. 2018 Dec 28;439:1-13.
[7] Klemm F, Joyce JA. Microenvironmental regulation of therapeutic response in cancer. Trends Cell Biol. 2015 Apr;25(4):198-213.
[8] Quail DF冲田杏梨番号, Joyce JA. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 2013 Nov;19(11):1423-37.